中国健康在线_中国健康行业垂直门户|传递健康养生资讯

导读
免疫检查点抑制剂(ICI)的出现彻底改变了肿瘤治疗格局。然而,ICI治疗相关的毒副作用(irAE)在很大程度上限制了ICI的疗效与应用。重症肌无力(MG)是一种严重的irAE,其特征是早发、多器官衰竭导致器官永久性损伤甚至死亡。且患者使用ICI后一旦出现MG,需立即停药,无法再从ICI治疗获益。目前临床上,通过生物标志物检测来富集ICI治疗优势人群已逐渐被认可,而对irAE的分子驱动机制仍缺乏了解。因此,识别和筛选潜在irAE生物标志物,明确irAE的分子驱动机制,实现ICI治疗的精确管理甚至早期预防至关重要。
江苏省人民医院郭人花教授团队报道了一例全外显子测序(WES)揭示irAE分子驱动机制的案例。一名胸腺瘤患者接受ICI治疗17天后发生MG伴多器官功能损伤,WES检测发现患者携带SLC22A5基因种系变异(c.1400C>G;p.S467C)。该基因发生变异会影响肉碱转运至肌肉细胞的效率,进而影响肌肉组织能量代谢。同时,ICI治疗会促使T细胞竞争使用肉碱,从而使得肌肉组织能量供应不足,发生MG。
基于上述机制,研究团队探索了左旋肉碱预处理后ICI再挑战的治疗方案,患者病灶得到部分缓解,且无MG相关症状。本研究创新性地探索了基因检测揭示irAE分子机制的可行性,依据基因检测结果,进一步实践了免疫治疗的精准个体化管理,使发生irAE患者成功实现免疫再挑战治疗。研究成果发表于Journal for ImmunoTherapy of Cancer(IF=12.469)[1]。
病例详情
一名男性胸腺瘤患者,38岁,术后两年发生复发转移。复发时无任何MG相关症状。
手术组织进行PD-L1表达和NGS检测,结果显示PD-L1表达阳性(TPS=30%,CPS=32), 且无ICI治疗相关负向或超进展基因标志物。患者接受ICI联合化疗,并取得了部分缓解。
17天后,患者出现右上睑下垂、复视,随后双眼睑下垂,伴有轻度呼吸和吞咽困难。实验室检查提示患者心肌酶谱异常,伴多脏器功能损伤,临床诊断为III级MG。
而后,江苏省人民医院免疫不良反应MDT团队积极采取对症治疗,患者的MG相关症状及指标逐渐恢复正常。
MG症状缓解后,研究者暂停ICI治疗,改为化疗方案,但患者对治疗无响应且发生了疾病进展(PD)。
基因检测揭示免疫治疗相关MG分子机制
由于缺乏后续的治疗方案,研究者考虑是否能够通过基因检测揭示MG发生机制,从而指导ICI再挑战。
研究者采集患者及其父母的外周血样本,进行WES检测,通过家系分析发现,患者携带母系遗传的SLC22A5基因杂合种系变异(c.1400C>G;p.S467C)。该基因编码高亲和力肉碱转运蛋白OCTN2,其功能缺失与全身原发性肉碱缺乏相关。
研究者进一步通过多种生物信息学方法预测分析SLC22A5(c.1400C>G;p.S467C)基因变异的致病性,发现p.S467C位点是一种稳定的突变(ΔΔGpred.=-0.347;MAESTRO分析),其可能会影响OCTN2蛋白的转运活性。既往报道显示,SLC22A5基因编码的蛋白负责转运肉碱,从而参与肌肉组织的主要能量代谢途径——脂肪酸氧化通路(FAO)[2]。
为验证这一问题,研究者进一步分析了GTEx数据库中SLC22A5基因、肉碱代谢和FAO通路的表达谱数据,发现它们均在肌肉组织中表达上调(图1),与肌肉组织能量代谢密切相关。上述分析表明,SLC22A2致病性基因突变,可能导致 OCTN2 蛋白的功能障碍,使胞内肉碱缺乏,影响肌肉组织通过FAO获取能量。
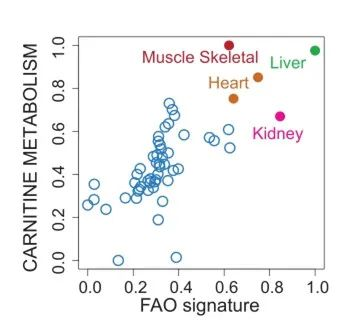

图1. SLC22A5、肉碱代谢和FAO通路在肌肉组织中高表达,与肌肉能量代谢密切相关
由于患者携带SLC22A5基因杂合种系变异(c.1400C>G;p.S467C),且未使用ICI前无MG症状,那么,ICI治疗是否会加重患者的能量代谢紊乱?针对这一问题,研究者分析了74例ICI治疗前后的T细胞mRNA数据(GSE141479)。结果发现,ICI治疗后,增殖相关标志物Ki-67和MKI67的表达显著升高(秩和检验,p=0.014),说明ICI治疗诱导T细胞增殖(图2A)。
此外, MKI67 mRNA表达水平与FAO的富集分数(通过单样本基因集富集分析,ssGSEA)相关(Spearman相关,rho=0.32;p=0.0056)(图2B)。这些研究结果共同表明,ICI治疗诱导T细胞增殖,由于增殖需要能量供给,T细胞中FAO通路活性上调,需要更多的肉碱,从而导致T细胞与肌肉细胞竞争肉碱(图2C),使得肌肉细胞能量供应减少,从而引起MG并发症。

图2. ICI治疗导致T细胞竞争使用肉碱,促进T细胞增殖
基因检测指导ICI再挑战成功
基于基因检测结果,患者携带的SLC22A5基因杂合种系变异(c.1400C>G;p.S467C)可能降低肉碱转运至肌肉细胞的效率,是ICI引起MG的风险因素。考虑到肉碱在FAO中的关键作用,研究者提出,ICI治疗中补充肉碱,可能会恢复肌肉组织的能量生成。因此,为防止再次发生MG,预先给予患者左旋肉碱进行补充,而后ICI再挑战。应用上述方案治疗后,患者病灶获得再次缓解(图3)且再无MG等irAE的发生。

图3. 免疫相关MG患者,免疫再挑战成功,病灶得到部分缓解
病例总结
该病例提示基因检测有助于准确识别irAE相关机制和早期诊断评估,并有助于临床个性化指导后续治疗策略。发生免疫相关MG的患者,应特别关注其FAO或其他能量代谢相关途径的基因变异,这些患者可能会从左旋肉碱治疗中受益,从而获得ICI再挑战的可能。
随着基因检测技术的进展,通过疗效预测生物标志物,富集免疫治疗应答者是克服ICI治疗应答率低的有效方法。而另一方面,通过检测irAE潜在风险基因,预测易发生irAE的患者,也同样重要。因此免疫治疗疗效预测、毒副反应预测的生物标志物探究,仍是重要的研究方向,为免疫治疗的个体化精准管理提供依据。
本研究使用了世和基因全外显子测序(WES)及世和一号®大Panel检测技术。
参考文献
[1] J Immunother Cancer. 2022 Nov;10(11):e005970. doi: 10.1136/jitc-2022-005970.
[2] Biochim Biophys Acta. 2016 Oct;1863(10):2422-35. doi: 10.1016/j.bbamcr.2016.01.023. Epub 2016 Jan 29.
上篇: 轩竹生物全速前进,自主研发创新药吡罗西尼获批开展II期临床试验
下篇: 返回列表

形体健康管理(BHM)是什么?|兰超汇美体内衣篇:作为新品类的美体内衣
